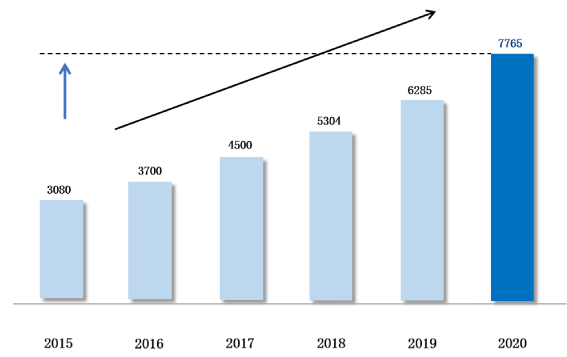
X 2.5
倍2015 年医疗器械
市场容量
1.023 Million
家医疗机构
35,000
家医院
9.11 Million beds
医疗机构床位数
粤港澳大湾区
优惠政策
全国同步的医疗器械市场准入机制
对于已在香港或澳门上市的具有CE或FDA认证,但未取得NMPA证书的医疗器械,大湾区定点医疗机构可在获得广东省政府批准后,采购香港和澳门公立医院正在使用中临床急需进口和具有先进临床技术的医疗器械。
真实世界数据政策
对于临床急需进口的医疗器械,可使用真实世界数据进行内地NMPA注册。
海南自由贸易港
优惠政策
真实世界数据策略 [- 进 口医疗器械 - ]
与大湾区政策类似,对于临床急需的进口医疗器械,可以使用真实世界数据进行NMPA注册。
关税和税收政策 [ - 合资国产医疗器械 - ]
鼓励类产业企业生产的商品通过“二线”进入中国大陆,对商品免征进口关税并享受征税优惠政策(即海南自由贸易港到其他地区)。
Start Business in CHINA
Various investment support from Fosun Pharma are available to help manufacturers adjust their business strategy with flexibility
投资 中国
独资企业

咨询 服务
美中互利提供
合资企业

财务支持

人力资源

土地资源
美中互利 & 复星医药提供
很遗憾,除非制造商在中国设有具有资质的分支机构来处理注册问题,否则这是不合法的且不合规的,进而,海外制造商必须指定中国代理人进行医疗器械注册。
对于NMPA注册费,进口医疗器械第二类医疗器械注册费为21.09万元,第三类医疗器械注册费为30.88万元。此外,还应考虑其他可能的费用,例如文件翻译费、临床试验费等。
注册材料经国家药监局受理后,第二类医疗器械技术审评需要60个工作日,第三类医疗器械技术审评需要90个工作日。国家药监局要求补充材料的,生产企业有义务在一年内提交,否则可能终止评审。
有 CE 或 FDA 证书的医疗器械可以在没有 NMPA 注册证的情况下进入特别行政区。对于大湾区和海南省作为试点地区,在香港或澳门已上市的医疗器械,经当地政府批准,试点地区定点医疗机构愿意采购临床急需医疗器械的,可进入试点地区。
京ICP备11010059号-1  京公网安备11010502035116号 (京)网药械信息备字(2023)第 00034 号 版权所有©美中互利(北京)国际贸易有限公司
京公网安备11010502035116号 (京)网药械信息备字(2023)第 00034 号 版权所有©美中互利(北京)国际贸易有限公司
京公网安备11010502035116号